具有生物功能的Janus颗粒可促进巨噬细胞吞噬肿瘤细胞
时间:2020-10-24 09:33来源:未知 作者:二九 点击: 次
合成颗粒的命运和生物学性能在很大程度上受到其纳米生物界面的影响。许多研究表明,颗粒的性质,例如大小,形状,表面化学性质和机械刚度,对颗粒与细胞之间的相互作用具有深远的影响。例如,Chan和他的同事们探索了利用DNA来构建具有形变特性的纳米结构的方法,以便他们可以改变叶酸的表现形式,从而优化其生物学功能。但是,细胞对纳米颗粒的反应通常不能通过单个配体-受体识别来确定。在许多情况下,不同事件的集体信号会启动生物过程。例如,T细胞活化需要两个同时的信号:T细胞受体特异性信号和共刺激信号。在这种情况下,需要将不同的配体结合到合成颗粒的设计中以获得理想的颗粒-细胞反应。Schneck的研究小组率先设计和开发了合成颗粒,将其作为人工抗原呈递细胞(aAPC)用于体外激活T细胞。作为前进的一步,Chiang 等。内置抗 CD3,抗-CD28和抗 -PD-L1抗体结合在IO @ FuDex纳米颗粒上,可同时激活T细胞和抑制检查点,从而实现更有效的癌症免疫治疗。尽管取得了这些进展,但将不同的配体结合到同一颗粒上仍具有挑战性,并且可能导致意想不到的相互干扰,从而损害其生物学功能。
在单个实体中可以在空间上显示不同功能的配体的Janus粒子(JP)可以独特地应对这一挑战。为多种生物医学应用而开发,包括微/纳米致动,生物传感,药物输送,和诊断学,JP具有许多均质颗粒无法提供的有前途的功能。例如,Leong及其同事开发了一种基于Janus纳米棒的基因传递系统,该系统可以同时结合质粒DNA和靶向配体的不同部分,从而避免了DNA对靶向配体的潜在干扰。相同的纳米棒可以桥接树突状细胞和T细胞的相互作用。Yu小组发现JPs与均质细胞进入细胞的方式不同,并且进一步揭示了JPs能够比均匀地被相同数量的配体包被的颗粒更有效地激活T细胞。所有研究都证明了JP在操纵粒子与细胞相互作用中的潜在优势。但是,这些研究仅涉及JP与单一类型细胞的相互作用。
许多生物过程涉及自然界中的两个或多个生物实体。例如,需要APC(例如巨噬细胞)吞噬肿瘤细胞以有效地呈递抗原。已经开发出具有均质表面外观的23种配体和抗体修饰的纳米颗粒,用于控制巨噬细胞和肿瘤细胞的相互作用,以进行有效的癌症免疫治疗。然而,关于JP介导的不同类型细胞之间的细胞间相互作用的研究已被大大忽略。在这项研究中,我们展示了通过Pickering乳液和无铜点击化学的组合构建生物功能JP的通用策略(方案S1),并研究了JP如何影响巨噬细胞和B16F10肿瘤细胞之间的细胞间相互作用。
结果
为了用无铜点击化学方法构建JP,按报道制备了用叠氮基团官能化的二氧化硅颗粒(SP)。获得了三种不同的叠氮化物修饰的SP(SPA),尺寸分别为150±8 nm,450±10 nm和2.30±0.02μm(图S1A ),分别表示为SPA1,SPA2和SPA3。 。透射电子显微镜(TEM)显示颗粒具有相对单分散的尺寸分布(图1A和S1C,D )。FTIR光谱中2100 cm -1处的峰证明了叠氮化物基团的固定(图1B),并且这种变化还将颗粒zeta电位从-42略微增加到-26 mV(图S1B)。然后,采用以水为水相,熔融蜡为油相的Pickering乳液法26,制备SPA胶体和JPs的前体。扫描电镜(SEM)图像显示,所有SPA1,SPA2和SPA3均在胶体表面形成单层分布(图1C和S1E,F )。
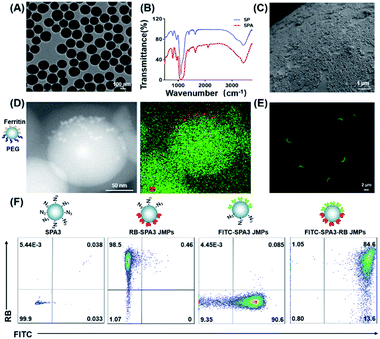
图1. 生物功能JP的制备和表征。(A)SPA1的TEM图像。(B)SP和SPA的FTIR光谱。(C)由SPA1稳定的蜡胶体的SEM显微照片。(D)PEG–SPA1–铁蛋白JNP的代表性TEM图像显示了硅(绿色)和铁元素(红色)的分布。(E)FITC–SPA3 JMP的荧光图像。(F)FITC–SPA3–RB JMP的流式细胞仪分析。
对制成的胶体进行随后的修饰以制备JP。为了确定Janus结构,采用了TEM和荧光成像。对于TEM观察,将SPA1制成的Janus纳米颗粒(JNP)与聚(乙二醇)(PEG)和铁蛋白在相反的面上(表示为PEG–SPA1–铁蛋白JNP)进行功能化。如图1D所示,可以在PEG–SPA1–铁蛋白JNPs的一侧看到铁蛋白斑块(〜10 nm),这也通过能量色散X射线光谱(EDS)中Fe元素的富集得到了证实。映射模式。对于荧光成像,将由SPA3制成的Janus微粒(JMPs)在一个半球上用异硫氰酸荧光素(FITC)标记(称为FITC–SPA3 JMPs),绿色荧光主要分布在微粒的一侧(图1E)。我们进一步制备了FITC和若丹明B(RB)标记的BSA,并将它们附着在SPA3的相对侧,以生成FITC–SPA3–RB JMP。荧光显微镜观察表明,绿色和红色荧光主要以空间分隔的方式分布在颗粒表面,而在均匀的FITC–SPA3–RB UMP中观察到两种荧光的分布更均匀(图S2 )。流式细胞仪分析定量表明,约有84.6%的颗粒同时被两种不同的染料染色(图1F)。为了证明该方法的多功能性,我们构建了一系列具有不同表面特性的JP,如表S1所示。
接下来,准备用相对的转铁蛋白(Tf)和BSA修饰的JNP(表示为Tf–SPA1-BSA JNP)以检查其对B16F10细胞的靶向能力,因为该细胞系过表达转铁蛋白受体(TfRs)。27对于荧光成像,使用了FITC标记的Tf–SPA1–BSA JNP。如图S3所示,†共聚焦显微镜显示,与未靶向FITC标记的SPA1颗粒相比,FITC标记的Tf–SPA1–BSA JNP在膜或B16F10细胞内部显示出明显增强的绿色荧光。但是,如果用游离Tf预处理细胞,则由于游离Tf与TfRs的竞争性结合,Tf–SPA1-BSA JNPs的细胞摄取明显减少。流式细胞术的定量分析与共聚焦显微镜成像非常吻合(图2A和B)。
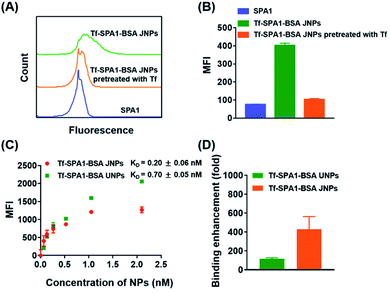
图2 Tf–SPA1–BSA JNPs对B16F10肿瘤细胞的体外靶向。在不存在或不存在游离Tf的情况下,与FITC标记的SPA1和FITC标记的Tf–SPA1–BSA JNP一起孵育的B16F10细胞的代表性流式细胞术直方图(A)和相应的平均荧光强度(B)。(C)FITC标记的Tf-SPA1-BSA JNP和Tf-SPA1-BSA UNP与B16F10细胞的饱和结合。(D)与游离Tf相比,两种纳米颗粒的结合亲和力增强。数据表示为平均值±SD(n = 3)。
接下来,我们研究了Tf–SPA1–BSA JNP与B16F10细胞的结合亲和力,与它们均等修饰的对应物(称为Tf–SPA1–BSA UNPs)相比,后者附着了相同数量的BSA和Tf(表S3 )。用Scatchard分析估计Tf–SPA1–BSA JNP,Tf–SPA1–BSA UNP和游离Tf 的解离常数(K D)。根据计算,Tf–SPA1–BSA UNP和Tf–SPA1–BSA JNP 的K D值分别为0.70±0.05 nM和0.20±0.06 nM,与之相比,结合亲和力提高了约110倍和400倍游离Tf(K D = 80.38±1.20 nM)(图2C,D和S4)。由于纳米颗粒-配体缀合物中局部表面配体密度的增加,这种增强表现出基于纳米颗粒的系统的多价作用。更重要的是,Tf–SPA1–BSA JNPs 的K D值也低于Tf–SPA1–BSA UNPs 的K D值,表明JNPs具有比均匀修饰的纳米粒子更高的结合亲和力。这可能为可能增强的粒子-细胞相互作用奠定基础。
上述研究证明了具有不同生物功能的一系列JP的构建。更有趣的是,我们发现在相同条件下,JPs对肿瘤细胞的结合亲和力比UNPs高。但是,粒子-细胞相互作用研究是针对单一细胞类型进行的。许多重要的生物学过程通常涉及不同类型的细胞。例如,在癌症免疫疗法中,需要巨噬细胞或树突状细胞吞噬肿瘤细胞以进行抗原加工。在这里,我们想知道这些JP是否会有效介导肿瘤细胞与巨噬细胞的相互作用。肿瘤细胞在膜上过表达CD47,CD47与巨噬细胞上的SIRPα结合以抑制吞噬作用。已证明,阻断CD47–SIRPα轴可增加肿瘤细胞的吞噬作用。因此,在这项研究中,我们选择了Tf和aSIRPα来制备Tf–SPA1–aSIRPα JNP,用于研究肿瘤细胞与巨噬细胞之间的粒子介导的相互作用。最重要的是,我们想验证Tf–SPA1–aSIRPα JNP是否可以分别与肿瘤细胞上的TfRs和巨噬细胞上的SIRPα结合。将eFluor 670标记的B16F10细胞或抗 -F4 / 80标记的骨髓巨噬细胞(BMDM)与Tf–SPA1–aSIRPα JNP一起孵育,并进行流式细胞仪分析(图S5和 3A,B)。可以看出,与每个游离配体相比,两种官能化的NP均显示出与B16F10肿瘤细胞或BMDM更强的细胞结合。此外,在肿瘤细胞(99.4%vs. 56.7%,p <0.001)或巨噬细胞(99.5%vs. 41.0%,)中,与 Tf–SPA1–aSIRPα JNP相比,Tf–SPA1–aSIRPα JNPs的细胞结合显着增强。p <0.001),表明Janus结构在介导细胞-颗粒相互作用中具有优势。
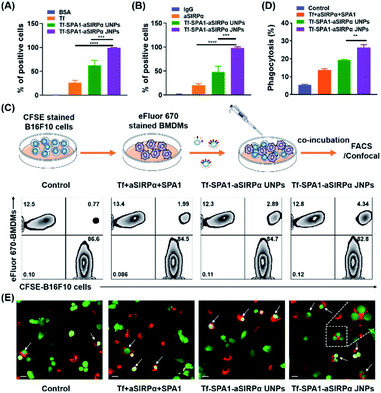
图3 Tf–SPA1–aSIRPα JNPs促进了体外吞噬作用。不同处理对B16F10细胞(A)和BMDM(B)的相对结合能力。B16F10细胞用eFluor 670标记,而BMDMs用APC 抗 -F4 / 80 标记。数据表示为平均值±SD(n = 3)。*** p <0.001;**** p <0.0001。(C)吞噬作用测定的示意图(上部)和用不同制剂处理的吞噬作用测定的代表性流式细胞仪分析图像(下部)。(D)通过BMDM对肿瘤细胞的吞噬作用的相对定量。数据表示为平均值±SD(n = 3)。**p<0.01。(E)吞噬作用测定的代表性共聚焦图像。比例尺:20μm。在(C),(D)和(E)中,B16F10细胞用CFSE标记(绿色),而BMDMs用eFluor 670标记(红色)。
在此基础上,我们进一步研究了纳米颗粒如何介导巨噬细胞与肿瘤细胞之间的相互作用。在相同条件下,将eFluor 670标记的BMDM和CFSE标记的B16F10细胞与Tf–SPA1–aSIRPα JNP和其他制剂共培养。流式细胞仪分析(图3C和D)表明,与游离Tf,游离aSIRPα和SPA1的物理混合物(表示为Tf +aSIRPα+ SPA1)相比,Tf–SPA1–aSIRPα UNP能够促进BMDM吞噬B16F10细胞。 ) 在某种程度上。Tf–SPA1–aSIRPα JNPs可以介导比Tf–SPA1–aSIRPα UNPs更高的吞噬作用(分别为19.4%和 25.3%,p<0.01),可能是由于它们与肿瘤细胞和BMDM的结合亲和力增加。此外,我们还使用共聚焦显微镜目测了纳米粒子介导的B16F10–BMDM相互作用(图3E),并证实与Tf–SPA1–SIRPα JNPs共培养后,更多的B16F10细胞可以被BMDM吞噬。
为了观察BMDM对B16F10细胞的吞噬作用,使用了2.30μmTf–SPA3–aSIRPα JMP,其伪色为蓝色,而BMDM和B16F10细胞分别显示了红色和绿色荧光。如共聚焦图像所示(图4A),我们可以看到与Tf–SPA3–aSIRPα JMP共孵育2 h后,更多的蓝色颗粒与BMDM和B16F10细胞结合。随着潜伏期延长至4小时,B16F10细胞被BMDM吞噬,用于Tf–SPA3–aSIRPα JMP处理,这表明Tf–SPA3–aSIRPα JMP可能介导更强的细胞间相互作用,因为它们对两个细胞的结合亲和力增强。为了进一步观察细节,在高含量分析系统上对吞噬作用进行了时程跟踪。在图4B中,我们可以清楚地看到蓝色的Tf–SPA3–aSIRPα JMP附着于B16F10细胞和BMDM,而B16F10细胞逐渐与BMDM接触,并最终与肿瘤细胞和JMP的吞噬作用达到顶点。
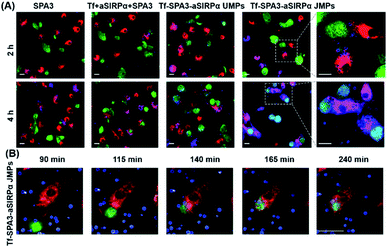
图4 Tf–SPA3–aSIRPα JMP促进BMDM相互作用和随后吞噬B16F10细胞。(A)分别用不同制剂处理2小时或4小时的吞噬作用测定的代表性共聚焦图像。(B)Tf–SPA3–aSirpα JMPs处理吞噬作用的时间依赖性。在(A)和(B)中,B16F10细胞用CFSE标记(绿色),BMDMs用eFluor 670标记(红色),颗粒用RB标记(蓝色)。比例尺:20μm。
结论
总而言之,我们开发了构建JP的通用策略,可以在空间上选择性地将不同生物分子固定在单个颗粒上。使用Tf作为靶向配体,我们发现JPs的解离常数显着低于均匀涂有相同数量配体的颗粒的解离常数,这表明Janus结构导致与Tf受体的肿瘤细胞结合亲和力增强过度表达。更重要的是,通过操纵粒子上Tf和aSIRPα的空间排列,我们证明了具有生物功能的JP能够同时靶向巨噬细胞和肿瘤细胞,从而促进肿瘤细胞的后续吞噬作用。时程跟踪成像表明,JPs可以介导吞噬过程。
利益冲突
没有要声明的冲突。
